三類醫療器械企業通過藥監審查的關鍵路徑
更新時間:2025年11月10日
三類醫療器械因直接涉及人體健康與生命安全,其生產、經營環節受到藥監部門的嚴格監管。企業若想順利通過藥監審查,需從法規遵循、體系構建、流程管控及技術工具應用四方面系統布局。
一、精準把握法規要求,筑牢合規根基
三類醫療器械的注冊、生產、經營需嚴格遵循《醫療器械監督管理條例》《醫療器械生產質量管理規范》等法規。企業需明確產品分類(如植入式器械屬高風險等級),確保技術文檔、臨床評價、生物相容性測試等材料符合國家藥監局標準。例如,細胞毒性、皮膚刺激等測試需按ISO 10993系列標準執行,臨床數據需來自兩家以上國家藥品臨床研究基地,并經倫理委員會批準。
二、構建全流程質量管理體系
企業需建立覆蓋設計開發、采購、生產、檢驗、銷售、售后的質量管理體系,并通過ISO 13485認證。生產環境需達到潔凈廠房標準(如萬級潔凈區),關鍵設備需定期校驗,人員需接受崗位培訓。同時,建立產品追溯系統,實現原材料來源、生產過程、產品去向的全鏈條可追溯。
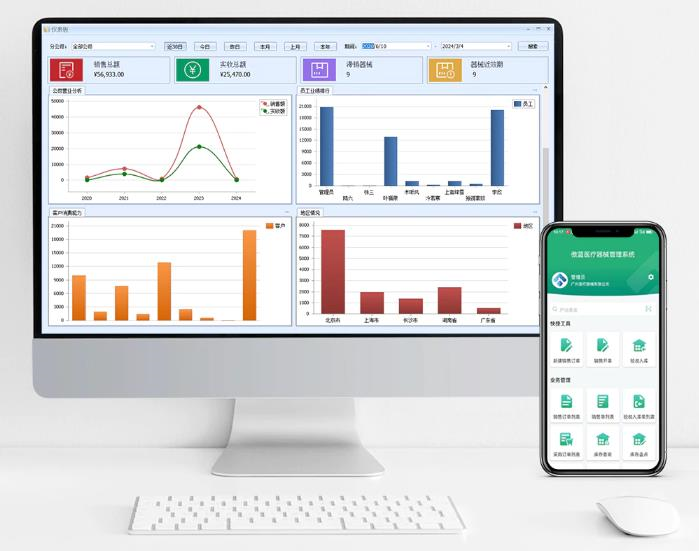
三、借助數字化工具提升審查效率
在流程管控中,數字化工具可顯著降低合規成本。以傲藍醫療器械軟件為例,其內置GSP管理模塊,支持掃碼建檔、批次追蹤、冷鏈監控等功能,能自動生成符合藥監標準的報表與文檔。企業通過軟件可實時管理庫存效期、供應商資質,避免過期產品流通,在辦理許可證時直接提交系統生成的記錄,大幅縮短審查周期。
四、強化動態監測與持續改進
企業需建立不良事件監測體系,定期開展質量管理體系自查,對原材料、工藝、設備等變更進行評估報備。同時,配合藥監部門的飛行檢查、專項檢查,確保生產過程持續符合法規要求。
通過法規精準落地、體系閉環管理、工具智能賦能及動態監測改進,三類醫療器械企業可構建起貫穿產品全生命周期的合規防線,在藥監審查中實現“一次通過”。